2001년 니시무라: Balb/c PD-1 결손 마우스에서 확인된 체액성 자가면역 기반 확장성 심근병증
발행: 2026-02-16 · 최종 업데이트: 2026-02-16
2001년 Hiroyuki Nishimura 연구는 Balb/c 배경의 PD-1 결손 마우스에서 확장성 심근병증이 발생함을 보고했습니다. 이 연구는 PD-1이 체액성 자가면역을 억제하는 핵심 면역관문임을 입증했습니다.
PD-1 결손은 항상 같은 자가면역을 일으키는가?
1998–1999년 연구에서 C57BL/6 배경의 PD-1⁻/⁻ 마우스는 시간이 지나면서 루푸스 유사 자가면역을 발병한다는 사실이 밝혀졌습니다. 그러나 면역학자들은 한 가지 중요한 점을 알고 있었습니다. 동일한 유전자 결손이라도 어떤 유전적 토양(strain background) 위에 있느냐에 따라 질병의 양상은 완전히 달라질 수 있습니다. 즉, PD-1이라는 브레이크가 사라졌을 때 터져 나오는 면역계의 약점은 개체마다 다르다는 점을 이 연구가 예견한 것입니다.
Balb/c 균주는 자가면역 감수성이 비교적 높은 계통으로 알려져 있습니다. 그렇다면 PD-1 결손이 Balb/c 배경에서는 어떤 결과를 초래할까요? 이 질문에 답한 연구가 2001년 히로유키 니시무라(Hiroyuki Nishimura) 연구팀의 보고입니다.
Balb/c 배경으로의 역교배와 생존 분석
연구팀은 PD-1 결손 유전자를 Balb/c 배경으로 10세대 이상 역교배(backcrossing)하여 유전적 배경을 안정화했습니다. 이후 생후 30주까지 생존율을 추적했습니다.
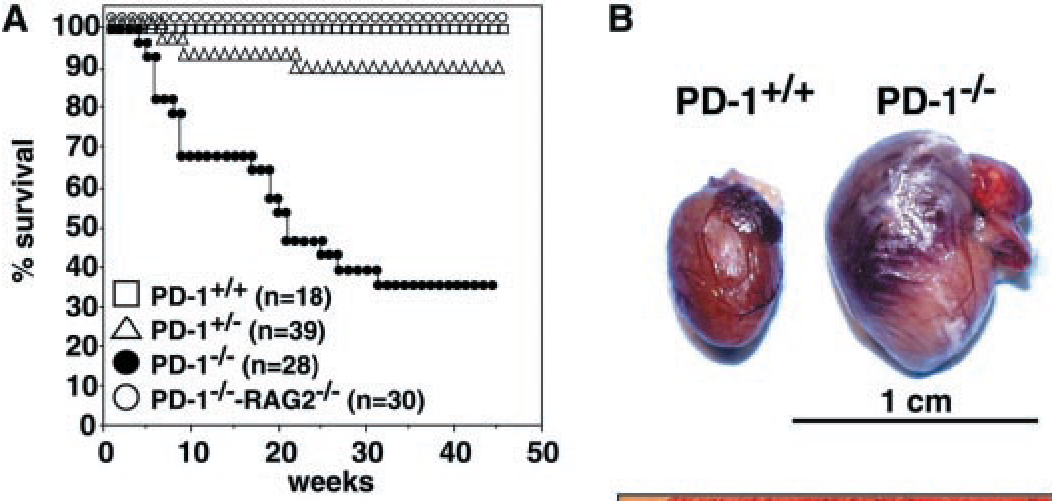
결과는 충격적이었습니다. Balb/c PD-1⁻/⁻ 마우스는 생후 5주부터 사망하기 시작했으며, 30주 이전에 약 3분의 2가 폐사했습니다. 이는 C57BL/6 PD-1⁻/⁻ 마우스가 비교적 정상 수명을 유지했던 것과 극명하게 대비되는 결과였습니다.
사망 원인은 확장성 심근병증
병리 분석 결과, 사망 개체의 심장은 전형적인 확장성 심근병증(dilated cardiomyopathy)을 보였습니다.
-
좌심실 확장
-
벽 운동 저하(hypokinesis)
-
울혈성 심부전 양상
심근세포는 늘어나고 얇아져 있었으며, 수축 기능은 현저히 감소해 있었습니다. 이는 단순 염증이 아니라 구조적 심근 기능 상실을 의미했습니다.
33 kDa 심근 단백질에 대한 자가항체
모든 Balb/c PD-1⁻/⁻ 마우스에서 심근세포 표면의 33 kDa 단백질을 인식하는 순환성 IgG 자가항체가 발견되었습니다. 당시 연구팀이 발견한 33 kDa의 자가항원은 훗날 심근 수축 조절에 핵심적인 트로포닌 I(Troponin I)임이 밝혀지며, PD-1이 어떻게 심장 면역 관용을 유지하는지에 대한 구체적인 기전 연구로 이어지게 됩니다. 면역침착은 심근세포막과 횡문(intercalated disc) 부위에서 두드러졌습니다.
중요한 점은 조직 내 염증세포 침윤이 거의 없었다는 사실입니다.이는 세포독성 T세포가 심장을 직접 파괴하는 '심근염(Myocarditis)'이라기보다, 자가항체가 심장 기능을 마비시키는 심근병증(Cardiomyopathy)의 양상임을 보여줍니다. T세포가 직접적인 '자객'이라면, 여기서는 자가항체가 심장 엔진의 부품을 고장 내는 '방해꾼' 역할을 한 셈입니다.
CTLA-4 결손과의 대비
이 결과는 CTLA-4⁻/⁻ 마우스와 뚜렷하게 대비됩니다.
-
CTLA-4 결손 → T세포 폭주형 면역병리, 심근염(cardiomyositis)
-
PD-1 결손(Balb/c) → 항체 중심 체액성 자가면역, 심근병증
CTLA-4가 면역계 전체의 폭발을 막는 '메인 전원 스위치'라면, PD-1은 **특정 장기에 대한 자가항체 생성을 정교하게 제어하는 '세부 조절기'**임을 이 대비가 명확히 보여줍니다.
RAG2 이중 결손에서 병리 소실
PD-1⁻/⁻ · RAG2⁻/⁻ 이중 결손 마우스에서는 심근병증이 완전히 사라졌습니다. RAG2는 T세포와 B세포의 항원수용체 재조합을 차단하므로, 이 결과는 질환이 적응면역계, 특히 항체 의존적이라는 점을 결정적으로 입증했습니다.
과학적 의의
첫째, PD-1은 B세포 및 항체 중심 자가면역을 강력하게 억제하는 핵심 분자임이 확인되었습니다.
둘째, PD-1 결손의 결과는 유전적 배경에 따라 표적 장기가 달라질 수 있다는 점이 제시되었습니다. C57BL/6에서는 루푸스 유사 신장병이 나타났고, Balb/c에서는 심장 특이적 심근병증이 발생했습니다. 이는 strain-specific autoimmunity라는 개념을 확립한 중요한 발견이었습니다.
셋째, 33 kDa 심근 자가항원을 중심으로 한 새로운 자가면역성 심근병증 모델이 제시되었습니다.
넷째, 이 연구는 이후 항-PD-1 면역항암제 치료에서 드물지만 치명적으로 나타나는 면역매개 심근염(immune-related myocarditis)의 생물학적 기반을 이해하는 데 중요한 단서를 제공했습니다.
일반인을 위한 정리
Balb/c 배경에서 PD-1을 제거하자 면역계는 자기 심장을 적으로 오해하기 시작했습니다. 염증세포가 대거 몰려오지는 않았지만, 심근세포 표면의 작은 단백질을 공격하는 자가항체가 조용히 심장을 손상시켰습니다. 심장은 점점 확장되었고 기능을 잃어갔습니다.
이 연구는 PD-1이 체액성 자가면역을 막는 중요한 방파제임을 극적으로 보여주었습니다.
참고문헌
-
Nishimura, H., Okazaki, T., Tanaka, Y., et al. “Autoimmune Dilated Cardiomyopathy in PD-1 Receptor-Deficient Mice.” Science, vol. 291, no. 5502, 2001, pp. 319–322. https://doi.org/10.1126/science.291.5502.319
-
Ishida, Y., Agata, Y., Shibahara, K., and Honjo, T. “Induced Expression of PD-1, a Novel Member of the Immunoglobulin Gene Superfamily, upon Programmed Cell Death.” EMBO Journal, vol. 11, no. 11, 1992, pp. 3887–3895. 논문 링크
-
Keir, M. E., Butte, M. J., Freeman, G. J., and Sharpe, A. H. “PD-1 and Its Ligands in Tolerance and Immunity.” Annual Review of Immunology, vol. 26, 2008, pp. 677–704. 논문 링크